1.ADC药物市场研究
抗体药物偶联物( antibody drug conjugate,ADC)是一种新型的靶向抗肿瘤药物,它利用单克隆抗体将连接的细胞毒药物靶向输送至肿瘤细胞部位,以增强抗体治疗活性、增加细胞毒药物杀伤肿瘤细胞的靶向性,并降低其对正常组织的毒副作用。虽然ADC药物结构复杂,但是其具有特异性高、选择性强和细胞毒性弱等优点。
美国 FDA 近年先后批准5种ADC药物上市,此外,在世界范围内还有数十种ADC候选分子已进入了临床研究。ADC药物已经成为肿瘤靶向治疗的研究热点与发展方向。以下为FDA已批准上市的5款ADC药物:
| 商品名 | 通用名 | 靶点 | 公司 | 批准时间 | 主要适应症 |
| Adcetris | Brentuximab Vedotin | CD30 | 武田 | 2011/8/19 | 霍奇金淋巴瘤 |
| Kadcyla | Ado-trastuzumab Emtansine | HER2 | 罗氏 | 2013/2/22 | 乳腺癌 |
| Besponsa | Inotuzumab ozogamicin | CD22 | 辉瑞 | 2017/8/17 | 急性淋巴细胞白血病 |
| Mylotarg | Gemtuzumab ozogamicin | CD33 | 辉瑞 | 2017/9/1* | 急性髓性白血病 |
| Polivy | Polatuzumab vedotin-piiq | CD79b | 罗氏 | 2019/6/10 | 复发或难治性弥漫性大B细胞淋巴瘤 |
*注:2017年9月1日为撤市后重新获批时间
数据来源:FDA,弗若斯特沙利文
在已上市ADC药物中,市场表现最好的为罗氏制药有限公司(Roche Pharma,以下简称“罗氏”)研发的靶向HER2的乳腺癌药物Kadcyla® (ado-trastuzumab emtansine),根据罗氏年报披露,2018年该药品全球销售额达到9.79亿瑞士法郎(约10.01亿美元),Kadcyla®的成功更加推动了ADC的研发热度。
Kadcyla®的适应症是晚期HER2阳性乳腺癌。乳腺癌(breast cancer,BC)是全球女性最常见的恶性肿瘤。在每年新发乳腺癌病例中,约3%-10%的妇女在确诊时即有远处转移。早期患者中,30%-40%可发展为晚期乳腺癌,5年生存率仅20%,总体中位生存时间为2-3年[1]。HER2是人表皮生长因子受体(human epidermal growth factor receptor,EGFR)家族蛋白的一员,作为酪氨酸激酶受体在调节细胞增殖、分化和生存等众多行为过程中发挥重要作用。HER2阳性乳腺癌约占全部乳腺癌的20%~25%,该类型乳腺癌侵袭性较高,预后差[2]。随着抗HER2药物的不断出现及广泛应用,HER2阳性乳腺癌患者的预后出现了非常显著的改善。
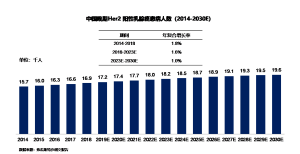
2014年到2018年间,中国晚期HER2 阳性乳腺癌患者的数量由1.57万增加至1.69万,年复合增长率为1.8%。预计到2023年中国晚期HER2 阳性乳腺癌患者人数将达到1.82万,随后患者人数将以1.0%的年复合增长率持续增长,并于2030年达到1.96万。
截至2019年6月底,中国有3款抗体偶联药物的临床试验已开展至II期及以后阶段,其中罗氏的Ado-Trastuzumab emtansine已递交NDA申请,百奥泰的BAT8001进入临床III期,荣昌生物制药(烟台)有限公司(以下简称“荣昌生物”)的RC48进入临床II期。下表为中国进入临床II期以上的抗HER2单抗偶联药物列表:
| 产品名称 | 公司名称 | 适应症 | 状态 |
药审中心承办日期/ 临床试验首次公示日期 |
| Ado-trastuzumab emtansine | 罗氏 | HER2阳性乳腺癌 | NDA | 2019-03-27 |
| HER2阳性胃癌 | II/III | 2014-09-09 | ||
| BAT8001 | 百奥泰 | HER2阳性乳腺癌 | III | 2018-02-22 |
| RC48 | 荣昌生物 | HER2阳性乳腺癌 | II | 2018-05-03 |
| HER2阳性尿路上皮癌 | II | 2018-04-13 | ||
| HER2阳性胃癌 | II | 2018-07-02 |
数据来源:CDE,弗若斯特沙利文报告
未来,受益于定点定量偶联技术、更优秀的小分子毒素开发应用以及抗体修饰技术的完善,加上癌症联合疗法的广泛应用,ADC技术有望步入大规模应用阶段。
2. IIb/IIIa受体拮抗剂市场研究
冠心病,又称“冠状动脉粥样硬化性心脏病”,是指因冠状动脉不同程度的受阻而引起的供血不足和心肌缺氧性心脏病,目前仍是全球范围内危害人类健康的“头号杀手”。抗血小板凝聚可显著降低冠心病患者的血栓事件风险,国内外指南均将抗血小板凝集类药物作为冠心病治疗的Ⅰ类推荐。
抗血小板凝集类药物种类众多,其中IIb/IIIa受体拮抗剂具有药效强、效果稳定等特点,在静脉和冠状动脉抗凝中广为应用。
根据弗若斯特沙利文数据,2018年中国PCI手术85万台,国内已有盐酸替罗非班等IIb/IIIa受体拮抗剂上市,2018年中国替罗非班市场规模约为2亿元。
3. 抗PD-1单克隆抗体市场分析
PD-1主要表达在活化的T淋巴细胞,B细胞,单核细胞,NK细胞和抗原呈递细胞上,作为调节免疫细胞功能的一个关键哨所,其一旦与表达在抗原呈递细胞上的PD-L1结合,便阻断PD-1信号通路传导,减少T细胞增殖和细胞因子释放,抑制抗肿瘤免疫。
抗PD-1单克隆抗体是针对PD-1靶点的单克隆抗体,能够抑制程序性死亡受体-1(PD-1)和其配体(PD-L1和PD-L2)结合,适用于多种实体瘤与血液肿瘤的治疗。
截至2019年6月底,中国已有5款已上市PD-1抑制剂,包括百时美施贵宝的欧狄沃®(纳武利尤单抗单抗)、默沙东的可瑞达®(帕博利珠单抗)、上海君实生物医药科技股份有限公司(以下简称“君实生物”)的拓益®(特瑞普利单抗)、信达生物的达伯舒®(信迪利单抗)以及、恒瑞医药的艾利妥®(卡瑞利珠单抗)。此外,百济神州(北京)生物科技有限公司(以下简称“百济神州”)的替雷利珠单抗于2018年递交NDA申请,另有百奥泰等多家PD-1抑制剂处于临床阶段。以下为中国已上市和已提交NDA的抗PD-1单抗药物列表:
| 产品名称 | 公司名称 | 适应症 | 状态 | 上市时间/药审中心承办日期 |
| 纳武利尤单抗 | 百时美施贵宝 | EGFR阴性,ALK阴性的局部晚期或转移性非小细胞肺癌 | 已上市 | 2018.6 |
| 帕博利珠单抗 | 默沙东 | 不可切除或转移性黑色素瘤 | 已上市 | 2018.7 |
| 特瑞普利单抗 | 君实生物 | 局部进展或转移性黑色素瘤 | 已上市 | 2018.12 |
| 信迪利单抗 | 信达生物 | 复发或难治经典型霍奇金淋巴瘤 | 已上市 | 2018.12 |
| 卡瑞利珠单抗 | 恒瑞医药 | 复发或难治经典型霍奇金淋巴瘤 | 已上市 | 2019.5 |
| 替雷利珠单抗 | 百济神州 | 复发或难治经典型霍奇金淋巴瘤 | NDA | 2018.8 |
胃癌细胞中存在Epstein-Barr病毒(EBV)者被称为EBV相关性胃癌(Epstein-Barr virus-associated gastric carcinoma, EBVaGC)。EBVaGC是一种具有独特临床病理学特征的胃癌亚型,其与年龄有强相关性。EBV感染后PD-L1和PD-L2表达上调,因而EBVaGC对PD-1/PD-L1免疫治疗敏感性较高。
EBVaGC与年龄有强相关性, 2014年到2018年间,中国新发EBV阳性胃癌患者的数量由3.20万增加至3.63万,年复合增长率为3.2%。预计到2023年中国新发EBV阳性胃癌患者人数将达到4.19万,随后新发患者人数将以2.6%的年复合增长率持续增长,并于2030年达到5.03万。

4.抗CD20单克隆抗体市场分析
自1997年第一个抗CD20治疗性单克隆抗体利妥昔单抗(rituximab,商品名美罗华®)批准上市至今,该类药物发展迅速。美罗华®联合化疗已成为多数B细胞NHL的标准一线治疗推荐,但仍有10%~15%的患者对美罗华®联合化疗反应不佳、无效甚至治疗有效后复发。
淋巴瘤是一种原发于淋巴结和(或)结外淋巴组织的淋巴细胞恶性肿瘤,以实体瘤形式生长于淋巴组织丰富的组织器官中。淋巴瘤可分为霍奇金淋巴瘤(HL)和非霍奇金淋巴瘤(NHL)。NHL是临床常见的造血系统恶性肿瘤。大多数NHL起源于B淋巴细胞,中国约95%的NHL患者CD20阳性。常见的NHL有弥漫性大B细胞淋巴瘤(DLBCL)、黏膜相关淋巴组织结外边缘区淋(MZL)、滤泡性淋巴瘤 (FL)、慢性淋巴细胞性白血病/小淋巴细胞性淋巴瘤(CLL/SLL)、套细胞淋巴瘤 (MCL)等。
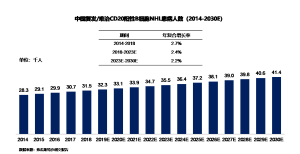
2014年到2018年间,中国复发/难治CD20阳性B细胞NHL患者的数量由2.8万增加至3.2万,年复合增长率为2.7%。预计到2023年NHL患者人数将达到3.6万,其年复合增长率为2.4%。随后患者人数将以2.2%的年复合增长率持续增长,并于2030年达到4.1万。
截至2019年6月底,中国仅有两款已上市抗CD20单克隆抗体注射液,分别为罗氏研发的美罗华®(利妥昔单抗)及复宏汉霖研发的汉利康®(利妥昔单抗生物类似药)。信达生物已递交NDA申请 ,神州细胞、海正药业、嘉和生物、正大天晴、华兰生物的抗CD20单克隆抗体注射液开展至临床III期阶段。下表列举了中国已进入临床III期及上市的抗CD20单克隆抗体。
| 产品名称 | 公司名称 | 适应症 | 状态 |
上市时间/ 药审中心受理日期 首次公示日期 |
| 美罗华® | 罗氏制药 | NHL | 已上市 | 2000/3/15 |
| 汉利康® | 复宏汉霖 | NHL | 已上市 | 2019/2/22 |
| RA | III | 2018/8/15 | ||
| IBI301 | 信达生物 | DLBCL | NDA | 2019/6/27 |
| SCT400 | 神州细胞 | DLBCL | III | 2016/6/6 |
| NA | 海正药业 | DLBCL | III | 2018/7/3 |
| GB241 | 嘉和生物 | DLBCL | III | 2018/11/28 |
| TQB2303 | 正大天晴 | DLBCL | III | 2018/12/11 |
| HL03 | 华兰生物 | DLBCL | III | 2019/4/17 |
5. 抗VEGF人源化单克隆抗体市场研究
重组抗VEGF人源化单克隆抗体是专门设计用于眼底病变治疗的IgG1型单克隆抗体,可通过中和VEGF,抑制VEGF与其受体VEGFR的结合,抑制血管新生,拟用于湿性年龄相关性黄斑变性(wAMD)、糖尿病性黄斑水肿(DME)和糖尿病性视网膜病变(DR)等眼底病变的治疗。
年龄相关黄斑变性(AMD)为视网膜黄斑区结构的衰老性改变,主要由视网膜色素上皮细胞和视网膜退行性病变引起的不可逆的视力下降或丧失。年龄相关黄斑变性在临床上分为干性年龄相关黄斑变性和湿性年龄相关黄斑变性(wAMD)两种,其中wAMD 更易导致严重的视力丧失,其主要病理特征是黄斑区脉络膜的新生血管形成。wAMD的物理治疗方法较多,但均无法改善患者的视力,从十多年前抗VEGF 药物问世以来,其作为治疗wAMD 的一线药物被广泛应用于临床。2006年,FDA批准Lucentis®(雷珠单抗)在美国上市,目前已获批包括湿性年龄相关黄斑变性(wAMD)和糖尿病性黄斑水肿(DME)等6个适应症。2012年,NMPA批准雷珠单抗用于wAMD的治疗,是国内首个用于眼科的抗VEGF类生物制剂药物。
wAMD多发生于45岁以上,发病率随年龄增长而增高。随着我国老龄化步伐的加快以及电子产品的普及,wAMD致盲性眼病的发病人数呈逐年上升趋势。2014年到2018年间,中国wAMD患者的数量由4,621万增加至5,257万,年复合增长率为3.3%。预计到2023年中国wAMD患者人数将达到5,565万,随后患者人数将以0.8%的年复合增长率持续增长,并于2030年达到5,883万。

截至2019年6月底,在眼底病变疾病治疗领域,国内已有雷珠单抗、阿柏西普、康柏西普3个抗VEGF药物获批上市。以下为中国已上市用于治疗眼底病变疾病适的抗VEGF药物列表:
| 产品名称 | 公司名称 | 适应症 | 状态 | 上市时间 |
| 雷珠单抗 | 诺华制药 | 湿性年龄相关性黄斑变性 | 上市 | 2011.12 |
| 阿柏西普 | 拜耳医药 | 湿性年龄相关性黄斑变性糖尿病性黄斑水肿 | 上市 | 2018.2 |
| 康柏西普 | 成都康弘生物科技有限公司 | 湿性年龄相关性黄斑变性 | 上市 | 2013.11 |
6. 抗Trop2单克隆抗体偶联物市场分析
三阴性乳腺癌 (triple negative breast cancer,TNBC)是乳腺癌的一个亚型,基于雌激素受体(ER)、孕激素受体(PR) 以及人类表皮生长因子受体2 (HER2)的表达状态,TNBC 是指 ER(-)、PR(-)、HER2(-)的乳腺癌。TNBC之所以成为乳腺癌亚型中的研究热点是因为 TNBC的特殊生物学行为,具有较其他亚型的乳腺癌更强的侵袭性,而且无病生存期较短,软组织及内脏转移率高,5年内死亡率较非TNBC患者高。
大约10-15%的乳腺癌是三阴乳腺癌,而Trop2(人滋养层细胞表面糖蛋白抗原2) 在80%的TNBC患者中过度表达,而正常组织中却低表达或不表达,因此Trop2成为理想的抗TNBC靶点。
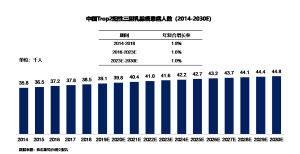
中国新发Trop2阳性三阴乳腺癌患者的数量由3.6万增加至3.9万,期间年复合增长率为1.8%。随着乳腺癌发病年龄年轻化,预计到2023年中国新发Trop2阳性三阴乳腺癌患者人数将达到4.2万,随后新发患者人数将以1.0%的年复合增长率持续增长,并于2030年达到4.5万。
BAT8003是百奥泰自主开发的一种创新药物,是国内首家针对该靶点提交IND的产品,全球尚无同品种产品上市。
7. 视神经脊髓炎谱系市场市场分析
视神经脊髓炎谱系(NMOSD)为高复发、高致残性疾病,90%以上患者为多时相病程,约60%的患者在一年内复发,90%的患者在3年内复发,多数患者遗留有严重的视力障碍和或肢体功能障碍、尿便障碍。2018年国家卫生健康委员会等5部门联合制定了《第一批罕见病目录》,视神经脊髓炎被收录其中。
2014年到2018年间,中国视神经脊髓炎谱系患者的数量由5.6万增加至5.7万,年复合增长率为0.5%。预计到2023年中国NMOSD的患者人数将达到5.9万,随后患者人数将以0.3%的年复合增长率持续增长,并于2030年达到6.0万人。

[1] 佚名. 中国晚期乳腺癌临床诊疗专家共识( 2018版)[J]. 中华肿瘤杂志, 2018, 40(9):703.
[2] Ross J S, Slodkowska E A, Symmans W F, et al. The HER-2 receptor and breast cancer: ten years of targeted anti–HER-2 therapy and personalized medicine[J]. The oncologist, 2009, 14(4): 320-368.


